El agua

Este estudio detallado de la química de la vida comenzará examinando las propiedades
del agua. Sus propiedades físicas le permiten funcionar como solvente de sustancias
iónicas y polares, mientras que sus propiedades químicas condicionan que forme
enlaces débiles con otros compuestos, incluso otras moléculas de agua. Las propiedades
químicas del agua se relacionan también con las funciones de las macromoléculas,
de las células y de los organismos completos. Dichas interacciones son importantes en
la estabilidad estructural de las macromoléculas y de las celulas. Se apreciará cómo
afecta el agua las interacciones de las sustancias que tienen poca solubilidad en ésta.
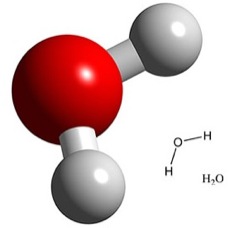
Algunas propiedades importantes del agua se deben
a la forma angulada y a los enlaces intermoleculares que puede formar. Un átomo
de oxígeno tiene ocho electrones y su núcleo cuenta con ocho protones y ocho neutrones.
Hay dos electrones en la capa interna y seis en la capa externa de este átomo. La capa
externa presenta el potencial de contener cuatro pares de electrones en un orbital s y
tres orbitales p. Sin embargo, la estructura y las propiedades del agua se pueden explicar
mejor si se supone que los electrones de la capa externa ocupan cuatro orbitales hí-
bridos sp3
. Imagínese el lector que esos cuatro orbitales ocupan las cuatro esquinas de
un tetraedro que rodea al átomo central de oxígeno. Dos de los orbitales híbridos sp3 de
un átomo de oxígeno contienen electrones aislados, lo cual significa que el oxígeno
puede formar enlaces covalentes con otros átomos, compartiendo electrones para llenar
dichos orbitales. En el agua, los enlaces covalentes implican a dos átomos distintos de hidrógeno, cada uno de los cuales comparte su único electrón con el átomo de oxígeno.

Además de sus propiedades físicas, las propiedades químicas del agua también son importantes
en bioquímica, porque las moléculas de agua pueden reaccionar con moléculas
biológicas. El átomo de oxígeno, rico en electrones, determina gran parte de la
reactividad del agua en las reacciones químicas.
La atracción entre uno de los átomos de hidrógeno, ligeramente positivo, de una molécula de agua y los pares de electrones parcialmente negativos en uno de los orbitales híbridos sp3 produce un puente de hidrógeno.
Concentraciones celulares y difusión
- Hipertónica: Disoluciones con mayor osmomolaridad. Una célula rodeada por una disolución hipertónica se encoge al salir el agua.
- Isotónica:Disoluciones de igual osmomolaridad. Una célula rodeada por una disolución isotónica no gana ni pierde agua.
- Hipotónica: Disoluciones con menor osmomolaridad en el citosol, Una célula rodeada por una disolución hipotónica se hincha al penetrar el agua.
Importancia biológica del agua
“El agua es el alma madre de la vida y la matriz, no hay vida sin agua”
Albert Szent Gyorgi.
 El agua es un compuesto inorgánico formado por dos átomos de hidrógeno y uno de oxígeno. Es la sustancia química más abundante que se puede encontrar en la naturaleza ya que ocupa tres cuartas partes de la superficie del planeta estando distribuida en 98% el cual corresponde a agua salada que se encuentra en mares y océanos, el agua dulce que poseemos en un 69% corresponde a agua atrapada en glaciares y nieves eternas, un 30% está constituida por aguas subterráneas y una cantidad no superior al 0,7% se encuentra en forma de ríos y lagos., ha estado presente en torno a 3.000 millones de años y constituye aproximadamente de 50% a 90% de los organismos.
El agua es un compuesto inorgánico formado por dos átomos de hidrógeno y uno de oxígeno. Es la sustancia química más abundante que se puede encontrar en la naturaleza ya que ocupa tres cuartas partes de la superficie del planeta estando distribuida en 98% el cual corresponde a agua salada que se encuentra en mares y océanos, el agua dulce que poseemos en un 69% corresponde a agua atrapada en glaciares y nieves eternas, un 30% está constituida por aguas subterráneas y una cantidad no superior al 0,7% se encuentra en forma de ríos y lagos., ha estado presente en torno a 3.000 millones de años y constituye aproximadamente de 50% a 90% de los organismos.
Los enlaces que mantienen unidos sus 3 átomos se denominan enlaces covalentes, lo que quiere decir que los átomos intercambian electrones en las ultimas capas de cada átomo, sin embargo en el caso del agua, el oxígeno posee gran cantidad de protones en su núcleo que su atracción no deja que los electrones viajen mucho por fuera, por lo que no se produce mucho intercambio, y esta propiedad se conoce como polaridad.
El agua comúnmente se suele considerar un líquido polar. Y como tal, actúa como un disolvente, permitiendo a otros líquidos y sustancias hidrófilas disolverse en ella.
Debido a que el agua tiene propiedades inherentes a su estructura, le permite realizar diversas funciones las cuales son sumamente imprescindibles para que haya vida, entre estas tenemos:
- Disolvente: La polaridad que tiene el agua entre sus propiedades la convierte en disolvente universal. El agua puede separar el soluto polar y puede disolver muchas sustancias diversas. Por supuesto, esta característica es vital para las reacciones que se dan en el cuerpo humano y en el cuerpo del resto de seres vivos ya que la mayoría de reacciones bioquímicas solo se dan dentro de soluciones acuosas.
- Función metabólica: Ya que posee tantos enlaces de hidrógeno tiene la capacidad de tomar el calor con mucha facilidad y calentarse, pero una vez caliente, tarda más en enfriarse, y esta característica es esencial para los procesos biológicos necesarios para la vida, donde el cuerpo necesita estar siempre a la misma temperatura, y cualquier variación puede ocasionar problemas o incluso la muerte.
- Función estructural: La elevada cohesión de las moléculas permite al agua dar volumen a las células, turgencia e inclusive actúa como esqueleto hidrostático en ciertos animales invertebrados.
- Función mecánica amortiguadora: Debido a que es un líquido incomprensible, cumple con esta función en las articulaciones de los vertebrados a modo del líquido sinovial.
- Función de transporte: Con su alta capacidad como disolvente le permite el transporte de ciertas sustancias en el interior de los organismos y su intercambio con el medio externo, mediante esto, se facilita el aporte de sustancias nutritivas y eliminación de desechos.
- Vida en bajas temperaturas: Su mayor densidad en estado líquido explica que al descender la temperatura, se forma una capa de hielo en la superficie, que flota y protege de los efectos térmicos del exterior al agua líquida que queda debajo; este hecho permite la supervivencia de muchas especies.
- Tensión superficial: Esta propiedad permite a algunos insectos apoyarse sobre la superficie, de modo que parece que andan sobre el agua, de lo que se aprovecha el insecto zapatero y algunos otros que son capaces de vivir con el oxígeno que se introduce en forma de burbujas en el interior.

No hay comentarios.:
Publicar un comentario